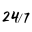轉載從: Tech News 科技新報
由於試驗成效不彰,美國生技大廠 Biogen 和日本製藥公司衛采(Eisai)3 月宣布終止阿茲海默症藥物 aducanumab 的 3 期臨床試驗,但情況近期出現大逆轉。整理試驗分析並看到可用數據後,Biogen 宣布重啟 aducanumab 計畫並將提交上市申請,如果一切順利,這將成為美國 17 年來第一種獲批准的阿茲海默症新藥。
據了解,Biogen 開發的 aducanumab(又名為 BIIB037)是靶向 β 澱粉樣蛋白抗體,2015 年 1 期臨床試驗中期結果公開後,一直受到全球市場密切關注,然而在進入 3 期臨床試驗後,試驗結果便一直不如 Biogen 預期。
至今年 3 月,團隊已收集並分析 EMERGE(1,638 人)和 ENGAGE(1,647 人)兩項 3 期臨床實驗中 1,748 例完成 18 個月研究的數據,獨立分析小組建議已不太可能達成主要研究終點後,Biogen 和衛采宣布中止研究。消息傳出後,Biogen 股價下跌近 30%,創下 2016 以來新低。
然而沉潛 7 個月後,Biogen 忽然在 10 月 22 日宣布,與美國食藥署(FDA)協商確認後,將重啟 aducanumab 項目並準備提交申請。
Biogen 表示,後續整理並重新分析臨床數據後,確認 EMERGE 已達到主要試驗終點。從數據來看,高劑量 aducanumab 確實能減緩症狀進展,為阿茲海默症早期患者帶來重大益處。
Biogen 計劃在 2020 年向 FDA 提交 BLA 申請,雖然申請後的審查工作還得花 1~2 年,但如果一切順利,aducanumab 將成為 2003 年以來阿茲海默症治療領域的第一款新藥。
一些批評人士仍質疑 Biogen 對臨床結果前後判讀不一,但整體來說,市場態度仍傾向樂觀看待。儘管目前已有一些藥物能緩解阿茲海默症某些症狀,但直到現在,還沒有一種針對潛在病理學的藥物出現。
美國阿茲海默症協會首席科學家 Maria C. Carrillo 指出,在他看來,這是阿茲海默症領域的重要時刻。「我們不應該去想使用更完整數據得出的分析結果該不該獲得批准,這得交由 FDA 判定。」
- FDA Will Consider Biogen’s Controversial Drug as First New Alzheimer’s Treatment Drug in 17 Years
- Biogen’s potential new drug for Alzheimer’s disease gets cautiously optimistic review following presentation
(首圖來源:達志影像)