轉載從: Tech News 科技新報
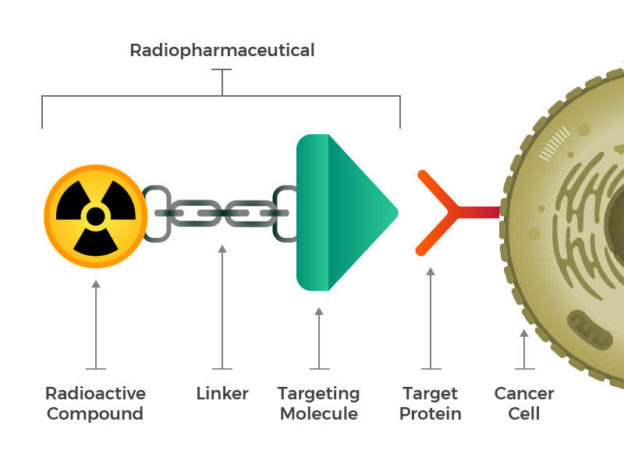
癌症標靶藥物與免疫療法都是癌症治療生力軍,已成功延長許多癌症病患的生命。然而科學家並不以此自滿,還在持續開發不同類型的抗癌新藥,「放射核種藥物」(radiopharmaceutical)正是另一種值得期待的新穎藥物。
傳統放射線治療的缺點
放射線用於治療癌症已超過百年(註 1),時至今日仍有約半數癌症病患在治療某階段會接受放射線治療。雖已歷經一世紀多,但放射線療法進展仍相當緩慢──放射線必須由病患「體外」照射入「體內」腫瘤區域,破壞癌細胞的 DNA 藉此消滅腫瘤。此作法下放射線也會通過正常組織,導致殺死癌細胞時許多正常健康細胞也遭波及,因此副作用不小,如掉髮、喪失味覺、性功能障礙及腹瀉等皆有可能發生。
放射核種藥物的前身
一是 1940 年代治療某些甲狀腺癌病患、稱為放射性碘(radioactive iodine)的療法,此法利用碘在人體內會自然積聚於甲狀腺的特性,當病患服用放射性碘後,就能聚積在甲狀腺並殺死手術後殘留的甲狀腺癌細胞。
相隔 70 多年,2013 年另一種治療轉移到骨骼的癌症藥物「二氯化鐳 223」(radium 223 dichloride,Xofigo)獲准用於治療轉移性「前列腺癌」,當癌細胞在骨骼內生長時,會損壞骨骼組織,此時身體會嘗試修復這些損傷,由於放射性元素鐳與鈣原子十分近似,因此會當成鈣而融入骨骼修復活動最旺盛的區域(如癌細胞正在增長的區域),此時放射性鐳就能發揮作用,殺死周遭癌細胞。
除了上述 2 種放射性藥物,似乎沒有其他藥物能不假外力導向腫瘤所在器官組織,因此科學家必須花費更多心思,研發能針對不同癌症發動攻擊的放射核種藥物。
放射核種藥物研發的突破進展
研究在 2018 年終於有了突破性進展,當年 FDA 批准諾華公司(Novartis)研發治療消化道「神經內分泌腫瘤」(neuroendocrine tumors,NET)的放射核種新藥 Lutathera(lutetium Lu 177 dotatate)。
神經內分泌瘤的癌細胞表面經常會有高量「體抑素受體」(somatostatin receptor)蛋白,顧名思義,這些受體會與一種稱為「體抑素」的生長素抑制因子蛋白結合,先前已有科學家研發出類似體抑素的蛋白藥物以緩解病患症狀、抑制腫瘤生長,現在科學家進一步將放射性元素鎦 177(Lu177,註 2)藉長度為 8 個胺基酸的胜肽,與體抑素類似蛋白接合在一起,成為放射核種新藥 Lutathera:體抑素類似蛋白將放射性元素攜帶至癌細胞表面,讓放射性元素能就近發揮作用毒殺周邊所有癌細胞。
放射核種藥物研發的展望
有了上述重要里程碑,如今科學家更積極開發用於治療肺癌、大腸癌及血癌等多種癌症的放射核種藥物。只要癌細胞表面有異常高量的特定蛋白質、可區分癌細胞與正常細胞的分子標靶,且患處具適當血液循環能使藥物經由血液輸送抵達癌細胞表面,那麼放射核種藥物就有機會發揮毒殺癌細胞的作用,幫助治療癌症。
結語
如今放射線治療終於有了新轉機,放射核種藥物將能更精準針對癌細胞。過去幾年,測試這類新藥的研究和臨床試驗數量不斷激增,試驗結果顯示放射核種藥物能更徹底消滅癌細胞,且無論短期或長期副作用皆可降低。專家相信,再 10~15 年,這類藥物必能將癌症治療推向另一個境界。
註 1:當放射性藥物附著(或進入)癌細胞後,放射性物質衰變釋放的能量會破壞鄰近細胞 DNA,當細胞 DNA 遭受無可挽回的損害時細胞就會死亡。此外,癌細胞對放射線造成的 DNA 損傷耐受力低於正常細胞,更容易死亡。
註 2:鎦 177 釋出的放射線粒子能量不會太強,只影響周圍 1 公釐範圍,所以對鄰近正常組織的影響小。
- Radiopharmaceuticals Are Showing Promise as the Next Generation of Cancer Treatment
- Radiopharmaceuticals: Radiation Therapy Enters the Molecular Age
(首圖來源:NIH)


