轉載從: Tech News 科技新報

這世界上有沒有一種新技術能讓科學界既期待卻又如此害怕受傷害呢?有的,答案就是「基因驅動工程」。它能將自身的基因以非常高的機率傳給下一代,也就是正常動物只要跟有基因驅動的動物交配,下一代幾乎百分百帶有基因驅動。而這樣的故事情節讓人振奮,因為許多傳染病因此得到消滅,但當冷靜下來仔細思考,這其中隱藏的危機卻又令人發顫。電影中的殭屍(zombie)不就是以這樣的傳播方式來感染正常人嗎?只要被殭屍咬上一口,過不久就會變成殭屍。如此迷人卻又令人擔憂的生物技術,其故事也同樣令人著迷。
瘧疾,是一種古老疾病,但依舊對人類產生很大的威脅,據估計 2015 年仍有 2.1 億人感染,造成約 44 萬人死亡,如何遏止甚至消滅瘧疾,是一項極為艱鉅的任務。與瘧疾的角力戰爭,可以從藥物治療著手。以往主要的藥物是奎寧,但由於許多染上瘧疾的患者對奎寧產生抗藥性,以及奎寧的用藥方式複雜使得病人配合度不佳,藥效越來越差,因此科學家一直在搜尋替代藥物。2015 年中國屠呦呦便是因為發現一種新的治瘧疾藥物──青蒿素,而獲得諾貝爾醫學獎;另一種對抗瘧疾的方式是控制瘧原蟲的傳播。瘧原蟲是以瘧蚊為傳播媒介,如果能更改瘧蚊的基因讓瘧原蟲無法在瘧蚊體內生存,瘧蚊便無從散佈瘧疾,不就等於消滅瘧疾了嗎?30 幾年前就有科學家提出此概念,但實際操作卻有很多問題要克服。
基改蚊的「先天」限制
加州大學爾灣分校的生物學教授 Anthony James 便懷有此想法,但要更改瘧蚊的基因並不容易,他花了 20 年才於 2011 年設計出會對瘧原蟲產生抗體的瘧蚊。接著卻面臨更大的問題,如果把這種抗瘧的基改蚊放到大自然裡,這種基因很快就會消失不見。原因在於基改蚊數量遠少於野生種數量,抗瘧基因很快會被群體稀釋掉而不見。此外,基改蚊對環境的適應力比較差。在物競天擇下,如今存活在人類生活周遭的每一種蚊子,其所擁有的基因都是隨著環境變異演化後的最佳結果,當我們用人為的方式去改變其中一段基因,便會弱化它的生存能力,所以基改蚊一般而言會競爭不過野生蚊子,最後逐漸被淘汰。
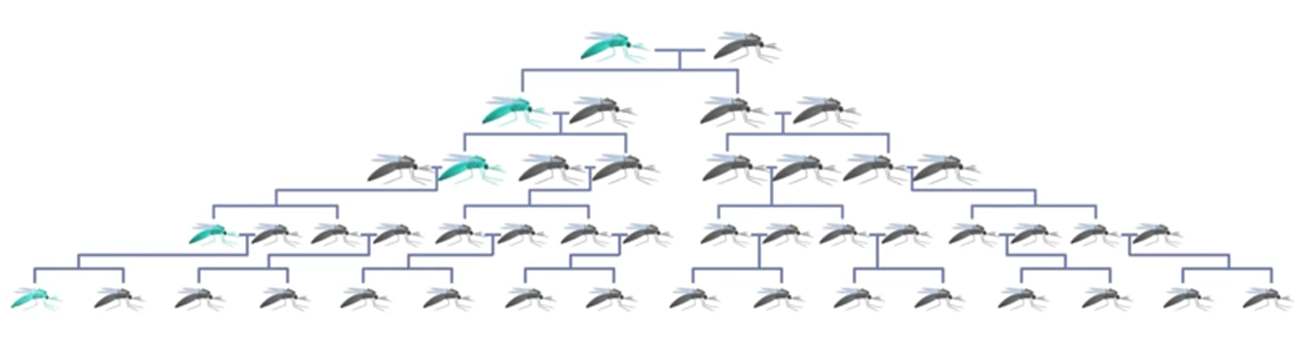
圖 1. 綠色代表基改蚊子,由於數量的劣勢最終會被野生種取代。(圖片來源:Sculpting Evolution)
基因也有自私型
抗瘧基因被群體稀釋掉的問題,或許能藉由以量取勝的方式來解決。如果野放夠多的基改蚊,那麼幾代後所有的蚊子都會有這樣的基因。不過據估計通常需 10 倍數量才能達到此目標,也就是如果這個村莊有 10 萬隻蚊子,就必須野放 100 萬隻基改蚊才能於數代之後改變族群的基因。想也知道這種方法就算可行,居民也不會接受。
那有沒有什麼方法可以讓抗瘧基因延續下去,卻不必野放那麼多基改蚊。科學家注意到生物中存在有一些特別的基因,會讓自己傳到子代的機率超過 50%,有這種特質的基因稱作自私基因(selfish gene)。根據孟德爾遺傳定律,父母身上的基因經過減數分裂形成精子或卵子,這個過程使得每個基因都恰好有 50% 的機率可以傳到子代,但是自私基因會將同源染色體某個特定位置切斷,然後鑲入自己的基因,這使得自私基因有超過一半的機會傳播給子代,它們是不遵守孟德爾遺傳定律的。
2003 年倫敦大學帝國學院的演化生物學家 Austin Burt,想到利用 HEG(homing endonuclease gene)這個自私基因來改變整個族群的基因。HEG 的 H 代表 homing,指的是「endonuclease gene」會自動返航(home),跑到同源染色體的相對位置。Burt 的想法是:首先用基因工程的方法改變 HEG 切割的位置,讓它去切一個對宿主很重要的基因,這個步驟叫基因剔除(gene knockout)。而這個被剔除的基因必須具備一個條件:單一基因被剔除時宿主沒有生存的問題,但當兩個都被剔除時,宿主便無法存活。接著想辦法將 HEG 置於減數分裂啟動子的控制下,使得宿主產生大量含 HEG 的配偶子,這樣帶有 2 個 HEG 缺陷基因的子代便會全數死亡。Burt 估計用這種方法只要放出 1% 的蚊子,20 個世代後便能完全消滅整個族群。
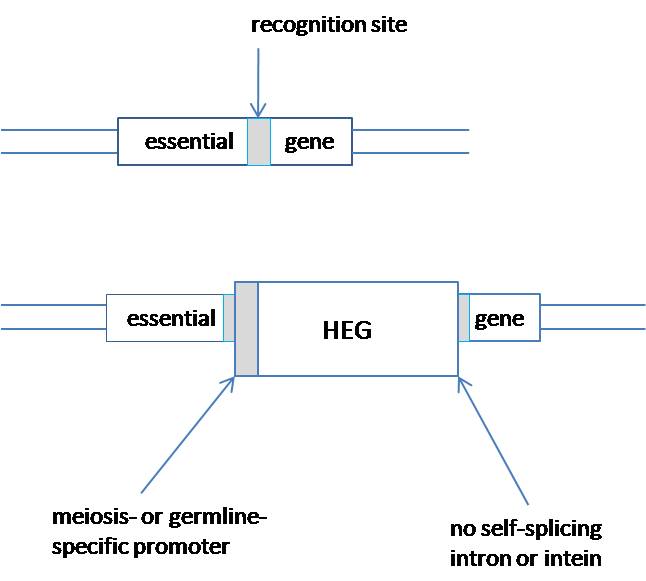
圖 2. HEG 插入一段重要的基因之中,造成基因剔除。(圖片來源:科技新報繪製)
基因驅動
這種「刺激有遺傳偏差的基因去影響整個族群」的做法就稱作「基因驅動」(gene drive)。改變的方法有加入、破壞、或是變更基因。基因驅動理論上有兩種設計方向,第一是改變重要的基因,讓擁有基因驅動的宿主無法傳播疾病;第二是改變性別比例,讓子代變成全都是雄性或雌性而無法產生後代。利用 HEG 作為基因的驅動器(drive)的想法很好,但實作卻不容易。主要是 HEG 要設計成能切割一個特定的基因很困難,因為自然界HEG有它偏好的切割位置。Burt 花了 8 年的時間,直到 2011 年才和 Nikolai Windbichler 等人成功地改變實驗室內含人工合成 HEG 瘧蚊的比例。
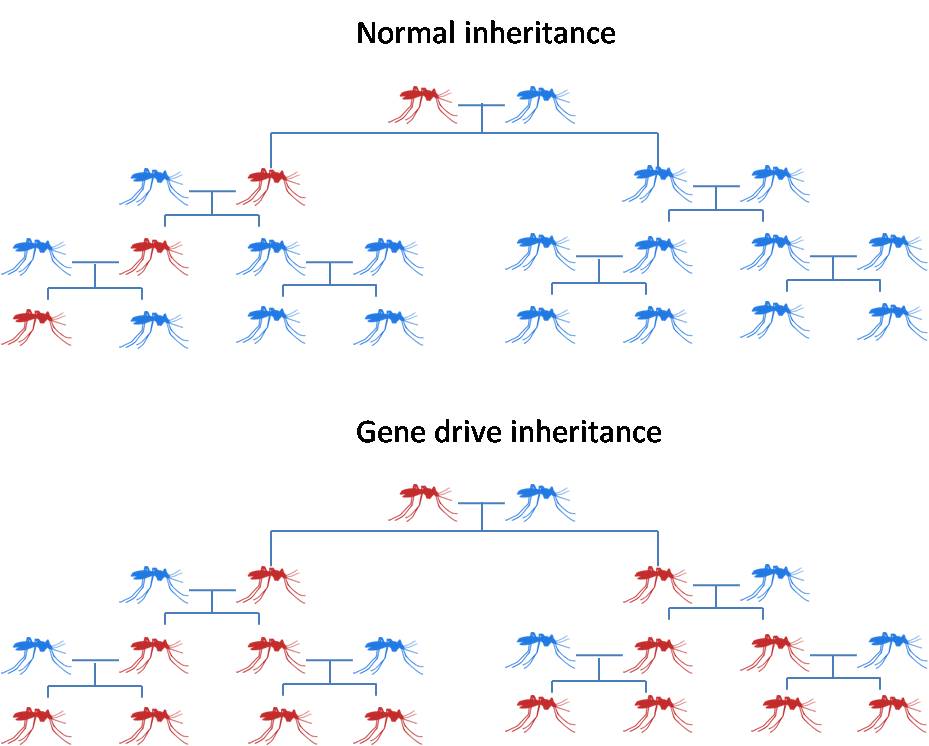
圖 3. 正常與有基因驅動的蚊子對後代族群基因影響有很大的差別。(圖片來源:科技新報繪製)
之後利用 HEG 設計基因驅動的行動就停滯不前,期間科學家也曾嘗試使用其它編輯基因的工具如 ZFN 和 TALEN。這兩種方法的確可以比較精確地找到基因的切割位置,只是當把它們做成基因驅動器時,科學家發現這樣的驅動器非常不穩定,傳播數代後效果就逐漸消失,所以這條路也不通。
這時生化界恰好發生一件大事,2012 年加州柏克萊分校的杜德娜(J. Doudna)和瑞典 Umeå 大學的夏虹緹(E. Charpentier)提出 CRISPR/Cas9 這套能精準切割基因的 DNA 編輯系統(參見 DNA編輯大師 CRISPR/Cas 一文)。簡單地說,這套系統是由一段擔任嚮導的 RNA 及具切割功能的核酸酶 Cas9 所組成。嚮導功能的 RNA 可以精準地將 Cas9 帶往目標位置、對 DNA 進行切割。這套 DNA 編輯系統由於精準、便宜、容易設計等優點,很快就獲得各實驗室採用,進而全面取代之前的 ZFN 和 TALEN。
以 CRISPR/Cas9 作為基因驅動
CRISPR/Cas9 發表後二年即 2014 年,哈佛的生物學家 Kevin Esvelt 想到如果把這套系統鑲嵌入染色體內,那不就是一個完美的基因驅動器嗎?因為 Cas9 和導引的 RNA 會精準切割染色體上特定位置,可以依需要進行基因敲入(knock in)或基因剔除。因為被切斷的染色體會以 Cas9 和所載送的基因為模板進行修復,最後兩條同源染色體都會有預定植入的基因、或缺乏的基因。妙的是這個過程在每一代產生配子時都會發生,因此能夠把這個機制不斷地傳給下一代,而且下一代都會是同型合子(homozygote)。

圖 4. 用基因驅動來進行基因敲入(A)或基因剔除(B)。(圖片來源:eLife)
基於此概念,加州大學聖地牙哥分校的 Ethan Bier 和 Valentino Gantz 於 2015 年初首先成功的改變果蠅身體的顏色,將果蠅由深棕色變成金黃色。之後他們又與 Anthony James 合作,將 James 之前製造帶有抗瘧基因的瘧蚊加入基因驅動器。實驗發現抗瘧雄蚊與野生蚊子的後代 99% 都會帶有這套基因,不過抗瘧雌蚊卻僅以略高於 50% 的機率傳給子代。
Austin Burt 的研究團隊也趕緊拋下 HEG 轉而擁抱 CRISPR/Cas9。同樣於 2015 年與 Andrew Hammond 等人共同發表研究成果。他們採用的是幫瘧蚊節育的方式,利用 Cas9 去切除雌蚊某隱形基因,讓雌蚊不孕。經過實驗這樣的基因驅動有 91~99% 的機率傳給下一代,理論上能夠逐漸降低瘧蚊的數量。
基因驅動工程的雙面刃
但所有的創新與研發都有其隱而未現的問題,基因驅動工程也不例外,它漂亮的數據令生物學家大感興奮,同時卻也讓他們憂心忡忡。它有可能發生下列幾種狀況:
1. 基因外流(gene flow):更改的基因可能從 A 族群通過交配流到 B 族群,造成 B 族群的基因也被改變。另一種更可怕的外流是從 A 物種通過雜交,把基因傳到相近的 B 物種。
2. 族群滅絕:基因驅動有能力改變族群性別比例,如產生全是雄性或雌性的後代,這樣便有可能消滅整個族群。
3. 基因突變:基因驅動器本身也可能產生突變,這種突變後的基因並不是我們原來想要的,但卻會傳播出去造成未知的傷害。
4. 生態改變:由於製造含基因驅動的物種並不困難,一些小實驗室就有能力完成,如果沒有嚴謹管控未來可能會對全球的農業、健康、和保育造成很大傷害。
有鑑於此,2015 年 7 月全球 27 位權威學者共聚一堂,如前述的 Ethan Bier、Austin Burt、Kevin Esvelt、Valentino Gantz、Anthony James 等,一起討論如何控管實驗室裡含有基因驅動的基改物種。最後他們從分子、生態、生殖、及環境屏障方面作出建議,這些方法有:
1. 將基因驅動器的各個關鍵元素分別放在不同的動物上,只有實驗時才把他們放在一起,或是令驅動器去切除野生種沒有的 DNA 序列。這樣萬一實驗動物逃出去也不能改變野生族群。
2. 只在沒有野生種的地方做實驗,例如在寒帶區域做熱帶動物的實驗,這樣實驗動物即使逃走也找不到對象交配。
3. 為每一種基因驅動器做反驅動器(a reversal drive)。萬一帶有基因驅動的基改動物造成危害時,馬上釋放含有反基因驅動的動物來中和。
4. 製造基因驅動的疫苗,讓尚未被傳染的野生物種可以對此驅動器免疫。
5. 加強基因驅動的特異性,避免基因外流造成對相近物種的危害。
防患於未然
世上有太多疾病是藉由蚊子傳染,除了瘧疾外還有曲弓熱(chikungunya)、黃熱病、西尼羅熱、登革熱等等。如果我們能夠控制這些蚊子,就能大幅降低這些疾病的危害,因為這些疾病要再找到新的宿主不是那麼容易。不過由於基因驅動的能力太大,所以雖然科學家已經在 2015 年就製造出能抑制瘧蚊數量或抗瘧原蟲的蚊子,卻遲遲不敢釋放到野外,因為會引起什麼效果沒有人知道,一旦有嚴重副作用將會是全球性的災難。
澳洲的生態學家 Ron Thresher 曾想用這項技術來消滅入侵澳洲河流的歐洲鯉魚,為此他拜訪了很多學者包括生態學家、環境學家、原住民、童子軍等等。每個人都問一個同樣的問題:萬一有條帶基因驅動的歐洲鯉魚跑回歐洲怎麼辦?理論上只要一條這樣的魚跑回歐洲,歐洲鯉魚就會滅種,因此科學家不敢輕舉妄動。美國 FDA 正在針對基因驅動這個問題研究討論。台灣也應推廣這方面的知識讓政客及民眾了解,如此才能凝聚共識,針對基因驅動的基改物種立法規範,並儘早防範。應當切記生物無國界,一旦在別的國家發生基改浩劫,台灣無法倖免於難,現在的登革熱疫情和茲卡病毒便是活生生的例子。
(首圖來源:Shutterstock)


